
五、化学成分实验
1) 碳酸锂含量的测定
(1)碳酸锂含量的测定实验流程见下图
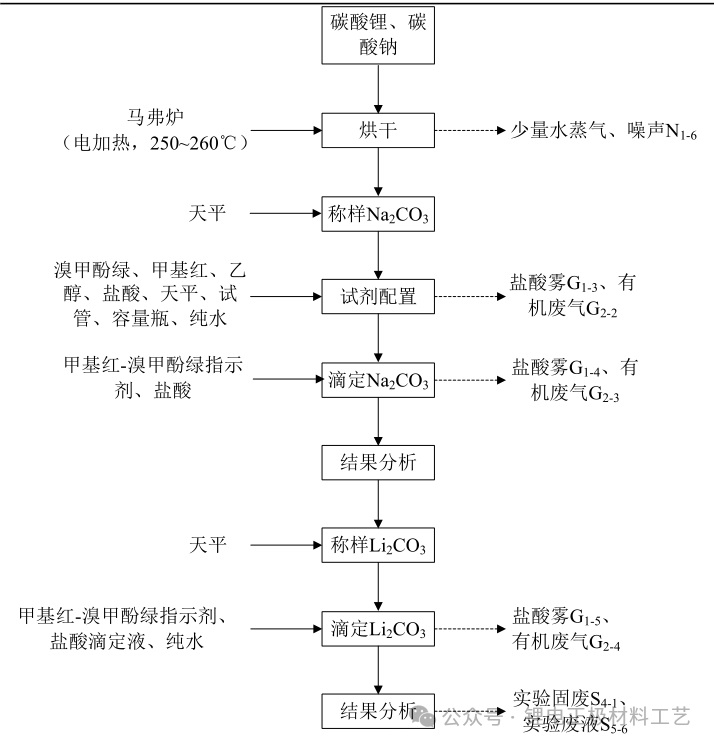
(2)实验流程简介:
① 烘干:碳酸锂试样来自周边新能源企业,此实验样品,碳酸钠为标定样品(测定盐酸浓度)。首先将碳酸锂、碳酸钠分别放置马弗炉内进行烘干,除去其中的水分,马弗炉采用电加热,温度设置在 250℃~260℃,时间 2h,烘干完成后,在干燥箱中冷却至室温。此实验步骤会产生少量水蒸气、设备噪声。
② 称样Na 2 CO 3:采用天平称取冷却后的 Na 2 CO 3 标定样 0.7200g,精确至 0.0001g。
③ 试剂:此实验主要配置甲基红-溴甲酚绿指示剂与盐酸标准滴定溶液,试剂配置过程在通风橱中进行。具体配置方法及过程如下:
*甲基红- 溴甲 酚绿 指示剂: 用天平称取 0.1g 溴甲酚绿,溶于 100mL 乙醇(95%)溶液中;用天平称取 0.2g 甲基红,溶于 100mL 乙醇(95%)溶液中;移取 30mL溴甲酚绿溶液和 10mL 甲基红溶液,混匀,即得到甲基红-溴甲酚绿指示剂。
*盐酸标准滴 定溶液:移取 25mL 盐酸(AR,ρ=1.17g/mL),置于 1000mL容量瓶中,用纯水稀释至刻度线,摇匀,即得到盐酸标准滴定溶液。此实验步骤会产生有机废气、盐酸雾。
④滴定 Na 2 CO 3:称取冷却后的 Na 2 CO 3 标定样 0.7200g,置于 250mL 三角瓶中,加入 50mL纯水溶解。溶解后在通风橱内进行滴定操作,加入 10 滴甲基红-溴甲酚绿指示剂,用盐酸标准滴定液滴定至溶液由绿色变为酒红色后,水浴煮沸 2min,除去溶液中的二氧化碳,冷却,继续滴定至溶液再呈现酒红色终点。同时进行两组平行实验,盐酸标准滴定液体积的极差值不应超过 0.10mL,取其平均值,并进行一组空白实验。此实验步骤会产生有机废气、盐酸雾。
⑤ 结果分析
*盐酸标准滴定溶液的实际浓度按下式计算:
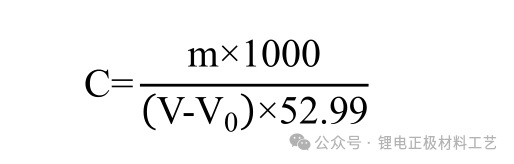
*式中:
C——盐酸标准滴定溶液的实际浓度,mol/L;
m——碳酸钠的质量,g;
V——滴定碳酸钠消耗盐酸标准滴定溶液的体积,mL;
V 0 ——滴定空白溶液消耗盐酸标准滴定溶液的体积,mL;
52.99——以(1/2Na 2 CO 3 )为基本单元的摩尔质量,g/mol。
⑥称样 Li 2 CO 3:采用天平称 Li 2 CO 3 试样 0.50g,精确至 0.0001g。
⑦滴定 Li 2 CO 3:将称取后的 Li 2 CO 3 试样置于 250mL 三角瓶中,加入 20mL 纯水溶解,滴入10 滴甲基红-溴甲酚绿指示剂,用盐酸标准滴定溶液滴定至试液由绿色变为酒红色,水浴煮沸 2min,除去溶液中的二氧化碳,冷却,继续滴定至溶液再呈现酒红色终点。此实验步骤会产生有机废气、盐酸雾。
⑧ 结果分析:碳酸锂的含量以碳酸锂的质量分数 W(Li 2 CO 3 )计,数值以%表示,按下式计算:
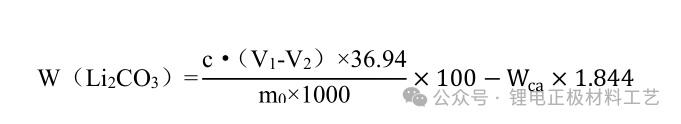
*式中:
C——盐酸标准滴定溶液的实际浓度,mol/L;
V 1 ——滴定试液消耗盐酸标准滴定溶液的体积,mL;
V 2 ——滴定空白消耗盐酸标准滴定溶液的体积,mL;
m 0 ——试样的质量,g;
1.844——单钙对碳酸锂的换算因数;
36.94 的换以(1/2Li 2 CO 3 )为基本单元的摩尔质量,g/mol;
W ca ——试样中钙的含量,%。
*实验结束后会产生实验固废、实验废液。

|



