关于电池材料和系统的 "突破 "或 "概念飞跃 "以解决相关环境问题的报道几乎每天都会出现在报纸、网页和期刊上。这些报道都配有醒目的文字,如能量密度增加一倍、两倍、更高、电动汽车充电只需几分钟、绝对安全等,并附有精美的图片。然而,在许多情况下,这些文章不包含或极少包含事实,也不强调严重的技术障碍。这些报道阻碍了电池研发的健康发展。客观地说,今后必须重视和解决电池的负面问题,以推动电池研发工作。本综述文章讨论了高能量密度锂电池中的大容量正极、高电压系统、浓缩电解质和可逆锂金属电极等隐藏的或经常被忽视的负面问题,并提供了一些可行的解决方案,以实现建造更高能量密度的现实可充电电池。对锂空气电池、多价穿梭电池、阴离子穿梭电池、硫阴极系统和全固态陶瓷电池的负面影响也进行了类似的客观讨论,有助于制造出更符合实际的电池。
1、这篇评论/前瞻性文章讨论了电池研发领域中隐藏或被忽视的障碍,以便科学家们能够避开这些陷阱,努力开发出更好的现实电池。文章将介绍研究人员小组的以下最新研究成果:i) 阴极材料中氧氧化还原的低能效方程电化学;ii) 阴极导电碳添加剂在高电位下的阴离子间位触发副反应;[iii) 设计多功能小溶剂分子,以替代昂贵、粘稠和低传导性的盐浓缩电解质; 以及 iv) 阴极和阳极同时发生巨大的 Nernst-Madelung 电位偏移,从而使金属锂等单一电极的电解质优化失效。此外,还针对每个问题提出了可能的解决方案。
2 高能氧氧化还原反应提供有限的额外能力
1)氧在富锂层状正极材料电化学反应中的参与使其容量的提高超过了传统的阳离子氧化还原极限[16-20]。O2-是氧化物固体正极材料中的一种常规状态。过渡金属完全氧化后,O2- 在层状结构中由 Li─O─Li 链接形成的弱 p 键 O2p 轨道的电化学氧化作用下,依次转变为 O- 自由基、O22- 二聚体和 O2 分子等几种化学状态。
2)O2-型堆叠化合物由沿堆叠方向的面共享八面体组成,强烈禁止过渡金属迁移,因为迁移的金属会受到强大的阳离子-阳离子排斥力的影响。通过逐渐增加上限截止电压,测量了其充放电曲线(图 1a)。得出的 dQ/dV 图提供了许多重要信息,如图 1b 所示。
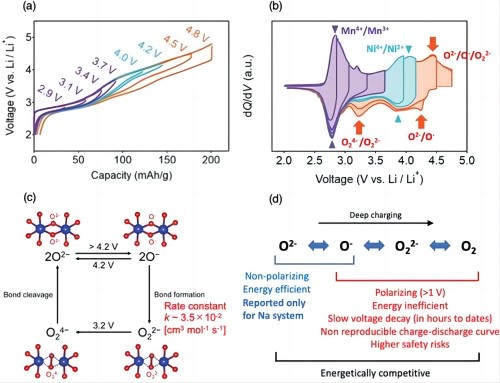
图 1 a)O2-Li1.12-yNi0.17Mn0.71O2 的恒流充电/放电曲线;b)C/20 处相应的 dQ/dV 图,上限截止电压从 2.0 V 升至 4.8 V 时 vs Li/Li+。c) 非极化/极化氧氧化还原反应的示意,O2- 在 4.2 V 以上被氧化成不稳定的 O-。Li/Li+ 会导致形成稳定的过氧化物 O22-,其速率常数为 k = 3.5 × 10-2 cm3 moL-1 s-1,而在 3.2 V 时,O22-还原为不稳定的 O24-,其速率常数为 k = 3.5 × 10-2 cm3 moL-1 s-1。d) 充电时氧氧化顺序和每个反应步骤问题的总结。只有第一步 O2- ↔ O- 是高能效的非极化氧化还原过程。
|



